ReaktionsgleichungSummenformeln aller beteiligten Stoffe
Als erstes musst du die Summenformeln aller Stoffe aufschreiben, die an der Reaktion beteiligt sind. Manche sind in der Aufgabenstellung versteckt. So gilt z.B. allgemein, dass bei einer Verbrennung Sauerstoff verbraucht wird.
Unterschieden werden Edukte und Produkte.
Edukte
Sind Stoffe, die bei einer Reaktion verbraucht werden. Sie stehen in der Reaktionsgleichung auf der linken Seite.
Produkte
Sind Stoffe, die bei einer Reaktion entstehen. Sie stehen in der Reaktionsgleichung auf der rechten Seite.
- Edukte
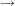 Produkte Produkte
Oxidationszahlen ermitteln
Falls das des Oxidations- und das Reduktionsmittels nicht bekannt sind, werden alle Oxidationszahlen ermittelt. Die Stoffe, deren Oxidationszahlen sich ändern, sind Oxidations- bzw. Reduktionsmittel.
Oxidationszahlen ausgleichen
Des weiteren sind die Summe aller Oxidationszahlen der Edukte gleich der Summe aller Oxidationszahlen der Produkte.
Ladungen und Atombilanz ausgleichen
Die Summe aller Ladungen der Edukte ist gleich der Summe aller Ladungen der Produkte. In wässrigen Lösungen kann meistens mit Hydroxid-, Oxonium- oder H_2O-Molekülen ausgeglichen werden.
Die Summe aller Atome eines Elementes auf der Eduktseite ist gleich die Summe aller Atome dieses Elementes auf der Produktseite.
Beispiel
- - Reaktion von Kaliumpermanganat mit 2-Propanol zu Propanon in saurer Lösung -
Summenformeln Edukte
Permanganat-Ion: KMnO - Das Kaliumion kann vernachlässigt werden, da es nicht an der Reaktion beteiligt ist
2-Propanol: 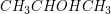
Summenformeln Produkte
Propanon: 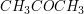
Permanganat(II)-Ion:  - Entsteht meistens bei der Reduktion von Permanganat - Entsteht meistens bei der Reduktion von Permanganat
Oxidationszahlen ermitteln
- Oxidationsmittel: Kaliumpermanganat
- Reduktionsmittel: 2-Propanol
Oxidationszahlen ausgleichen
lineares Gleichungssystem
a = c
b = d
7a = 2c + 2d
5a = 2d

Ladungen und Atomanzahl ausgleichen
weiteres Edukt:  -Ionen -Ionen
weiteres Edukt: Wasser
Ladungen: x - 2 = 4
Sauerstoffatome: 8 + 5 = 5 + y

|